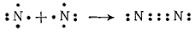Քիմիայում առավել հաճախ օգտագործվում է օքսիդացման աստիճան հասկացությունը: Որպեսզի հասկանանք այդ հասկացության իմաստը, համեմատենք լիցքերի առաջացումը նատրիումի քլորիդում` NaCI:
Նատրիումի քլորիդն առաջանալիս տեղի է ունենում էլեկտրոնի անցում նատրիումի ատոմից քլորի ատոմին, և առաջանում են լիցքավորված մասնիկներ` Na+ևCl− , որոնք էլեկտրաստատիկ ձգողության ուժերով ձգում են միմյանց՝ առաջացնելով իոնային բյուրեղավանդակ:
Բյուրեղավանդակում Na+ևCl− իոնների թվի հարաբերությունը կազմում է 1:1, որի պատճառով նատրիումի քլորիդ նյութի համար ընդունված է NaCI բանաձևը, չնայած պինդ վիճակում այդպիսի մոլեկուլ գոյություն չունի:
Բոլոր իոնային միացությունները գրառում են այնպիսի քիմիական բանաձևերով, ինչպիսիք ընդունված են մոլեկուլային միացությունների համար:Իոնային միացություններում տարրի վալենտականությունը հավասար է իոնի լիցքին:
Մոլեկուլն առաջանալիս տեղի է ունենում ընդհանուր էլեկտրոնային զույգի շեղում դեպի էլեկտրաբացասական տարրի ատոմը, որի հետևանքով ատոմները ձեռք են բերում մասնակի դրական, կամ մասնակի բացասական լիցք:
Քիմիական միացություններում ատոմների նման վիճակը բնութագրելու համար ընդունված է այդ լիցքերը հաշվել ոչ թե մասնակի, այլ ամբողջական:
Որպեսզի պայմանական լիցքը չշփոթեն իոնի լիցքի հետ, այն անվանել են օքսիդացման աստիճան:
Տարրի օքսիդացման աստիճանը պայմանական այն լիցքն է, որը քիմիական միացության մոլեկուլում վերագրվում է ատոմին` ենթադրելով, թե միացությունը կազմված է միայն իոններից:Օքսիդացման աստիճանը նշանակվում է արաբական թվանշանով, դրվում է քիմիական նշանի վերևում, ընդ որում սկզբից գրվում է նշանը (+ կամ –), ապա՝ լիցքի թվային արժեքը:
Օրինակ
Քլորաջրածնի մոլեկուլում ջրածին տարրի օքսիդացման աստիճանը +1 է, իսկ քլորինը` –1, որն էլ գրառվում է այսպես՝ H+1Cl−1:
Օքսիդացման աստիճանի մեծությունը որոշվում է միացության մոլեկուլում դեպի տվյալ ատոմը կամ տվյալ ատոմից շեղված էլեկտրոնների թվով:
Օքսիդացման աստիճանը կարող է ունենալ դրական, բացասական և զրոյական արժեքներ:
Երբեմն օքսիդացման աստիճանը թվապես համընկնում է տվյալ միացության մոլեկուլում տարրի ատոմի վալենտականությանը:
Օրինակ
Ածխածնի (IV) օքսիդի մոլեկուլում CO2 բաղադրիչ քիմիական տարրերի` ածխածնի(C) և թթվածնի(O) ատոմների և’ վալենտականությունները, և’ օքսիդացման աստիճանները (բացարձակ արժեքով) համապատասխանաբար հավասար են՝ 4 և 2:
Սակայն միշտ չէ, որ նշված մեծությունները համընկնում են: Պարզ նյութերի, օրգանական միացությունների մոլեկուլներում հիմնականում չեն համընկնում: Ազոտի N2 մոլեկուլում ազոտի ատոմի վալենտականությունը 3 է (N≡N), մինչդեռ օքսիդացման աստիճանը՝ զրո: Միացությունում ավելի մեծ էլեկտրաբացասականությամբ քիմիական տարրի ատոմի օքսիդացման աստիճանը բացասական է, իսկ կապեր առաջացնող մյուս տարրերի ատոմներինը՝ դրական:
Օքսիդացման աստիճանը, ինչպես և վալենտականությունը կարող են լինել հաստատուն և փոփոխական:Փոփոխական օքսիդացման աստիճանները միացություններում որոշվում են ըստ բանաձևի:Տարրերի օքսիդացման աստիճանները որոշելիս անհրաժեշտ է պահպանել հետևյալ սկզբունքները.
1. Պարզ նյութերի մոլեկուլներում տարրերի ատոմների օքսիդացման աստիճանները միշտ հավասար են 0-ի:
Օրինակ
H02,O02,Cl02,Zn0
2.Ոչ մետաղների հետ առաջացրած միացություններում ջրածնի օքսիդացման աստիճանը հիմնականում +1 է, ակտիվ մետաղների հետ առաջացրած միացություններում` հիդրիդներում −1 է:
3. Թթվածինը միացություններում հիմնականում դրսևորում է –2-ի հավասար օքսիդացման աստիճան, պերօքսիդներում` –1:
Օրինակ
H2O2 -ում թթվածնի օքսիդացման աստիճանը –1 է:
4. I,II,III խմբերի մետաղների օքսիդացման աստիճանները հավասար են խմբերի համարներին, բացառությամբ I խմբի երկրորդական ենթախմբի:
5. Միացություններում բոլոր ատոմների գումարային լիցքը հավասար է զրոյի:
Պատասխանել հարցերին
1.Ի՞նչ եք հասկանում տարրի օքսիդացման աստիճան ասելով:
Որպեսզի պայմանական լիցքը չշփոթեն իոնի լիցքի հետ, այն անվանել են օքսիդացման աստիճան: Տարրի օքսիդացման աստիճանը պայմանական այն լիցքն է, որը քիմիական միացության մոլեկուլում վերագրվում է ատոմին` ենթադրելով, թե միացությունը կազմված է միայն իոններից:
2.Ինչպե՞ս է գրառվում օքսիդացման աստիճանը:
Օքսիդացման աստիճանը գրառվում է ՕԱ: Օքսիդացման աստիճանը նշանակվում է արաբական թվանշանով, դրվում է քիմիական նշանի վերևում, ընդ որում սկզբից գրվում է նշանը (+ կամ –), ապա՝ լիցքի թվային արժեքը:
3.Թվարկե ՛ք հաստատուն օքսիդացման աստիճան ունեցող տարրերը:
H ,O ,C, Na,F , AI, S, Zn